<span style="color: rgb(51, 51, 51); font-family: " pingfang="" sc",="" system-ui,="" -apple-system,="" blinkmacsystemfont,="" "helvetica="" neue",="" "hiragino="" sans="" gb",="" "microsoft="" yahei="" ui",="" yahei",="" arial,="" sans-serif;="" font-weight:="" 700;="" letter-spacing:="" 1.5px;="" background-color:="" rgb(237,="" 245,="" 252);"=""> 賽庫生物最近3篇引用文獻解讀——nature communications 2篇&ADVANCED SCIENCE 1篇.
01 組蛋白翻譯后修飾(hPTMs)介導的相互作用組研究工具開發(fā)——光親和新型探針
01 組蛋白翻譯后修飾(hPTMs)介導的相互作用組研究工具開發(fā)——光親和新型探針

[題目]:Development of nucleus-targeted histone tail-based photoaffinity probes to profile the epigenetic interactome in native cells(開發(fā)基于細胞核靶向組蛋白尾基的光親和探針,以分析天然細胞中的表觀遺傳相互作用組)
[發(fā)表期刊]:Nature Communications(IF=14.7)
[DOI號]:10.1038/s41467-024-55046-8
[發(fā)表單位]:合肥工業(yè)大學/中國科學技術大學/清華大學等。
[引用產品]:細胞系RAW264.7(CellCook)
[研究思路]:用于hPTM介導的蛋白互作研究的新型光親和探針開發(fā)
[研究內容]:組蛋白翻譯后修飾(hPTMs)在調節(jié)染色質相關的蛋白互作(PPIs)中起關鍵作用,本文將細胞穿透肽(CPP)和核定位信號(NLS)模塊整合到帶有光反應基團的hPTM肽中,通過Fmoc固相肽合成法(SPPS)合成一系列探針(如H3K4me3探針1)并對其進行優(yōu)化;通過共聚焦激光掃描顯微鏡(CLSM)和流式細胞術分析,證實NLS和CPP模塊對探針1核靶向至關重要,確定了最佳的CPP和NLS模塊組合。體外光交聯(lián)實驗表明,探針9能特異性捕獲H3K4me3介導的相互作用蛋白且對細胞活力影響小。在對HeLa細胞中H3K4me3相互作用組和RAW264.7細胞中hPTM相互作用組(H3K4me3、H3K9cr和H3K9la)分析中發(fā)現(xiàn)多個已知和潛在的H3K4me3結合蛋白及不同細胞系中hPTM相互作用組存在差異,并驗證了AF9與H3K9la的相互作用。
[創(chuàng)新點]:開發(fā)了一種能在天然細胞中原位分析的基于組蛋白尾部的核靶向光親和探針,未來可拓展到原代神經元和組織研究,還可結合SILAC定量蛋白質組學進一步探索。
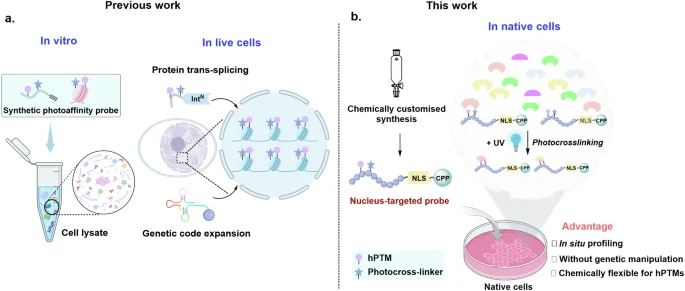
(hPTM介導的相互作用組示意圖)
02 基因毒性治療損傷修復新機制——VPS41促進KAI1降解

[題目]:EccDNA-Driven VPS41 Amplification Alleviates Genotoxic Stress via Lysosomal KAI1 Degradation(EccDNA驅動的VPS41擴增通過溶酶體KAI1降解減輕遺傳毒性應激)
[發(fā)表期刊]:Advanced Science(IF=14.3)
[DOI號]:10.1002/advs.202501934
[發(fā)表單位]:四川大學等
[引用產品]:細胞系HEK 293T(CellCook)、 A375(CellCook)、 SiHa(CellCook)
[研究思路]:篩選研究染色體外環(huán)狀DNA(EccDNA)關鍵基因在輻射損傷修復中的作用機制
[研究內容]:基因毒性療法(電離輻射等)是重要的癌癥治療手段,但會引發(fā)如放射性皮膚損傷(RISI)等副作用,目前缺乏有效治療方法。EccDNA與DNA修復、基因組不穩(wěn)定性有關,本文通過電離輻射構建大鼠放射性皮膚損傷模型,用Circle-Seq技術分析EccDNA篩選確認其中顯著上調的關鍵基因VPS41,并于體內外實驗中發(fā)現(xiàn)VPS41與KAI1相互作用可促進KAI1經溶酶體途徑降解從而抑制輻射誘導的細胞凋亡,VPS41過表達能降低輻射誘導的細胞內活性氧水平和DNA損傷,減少細胞凋亡和減輕炎癥反應。
[創(chuàng)新點]:本研究揭示了輻射誘導的EccDNA中VPS41通過促進KAI1溶酶體降解減輕輻射損傷的新機制,為基因毒性治療損傷修復提供了新策略。
[發(fā)表期刊]:Advanced Science(IF=14.3)
[DOI號]:10.1002/advs.202501934
[發(fā)表單位]:四川大學等
[引用產品]:細胞系HEK 293T(CellCook)、 A375(CellCook)、 SiHa(CellCook)
[研究思路]:篩選研究染色體外環(huán)狀DNA(EccDNA)關鍵基因在輻射損傷修復中的作用機制
[研究內容]:基因毒性療法(電離輻射等)是重要的癌癥治療手段,但會引發(fā)如放射性皮膚損傷(RISI)等副作用,目前缺乏有效治療方法。EccDNA與DNA修復、基因組不穩(wěn)定性有關,本文通過電離輻射構建大鼠放射性皮膚損傷模型,用Circle-Seq技術分析EccDNA篩選確認其中顯著上調的關鍵基因VPS41,并于體內外實驗中發(fā)現(xiàn)VPS41與KAI1相互作用可促進KAI1經溶酶體途徑降解從而抑制輻射誘導的細胞凋亡,VPS41過表達能降低輻射誘導的細胞內活性氧水平和DNA損傷,減少細胞凋亡和減輕炎癥反應。
[創(chuàng)新點]:本研究揭示了輻射誘導的EccDNA中VPS41通過促進KAI1溶酶體降解減輕輻射損傷的新機制,為基因毒性治療損傷修復提供了新策略。
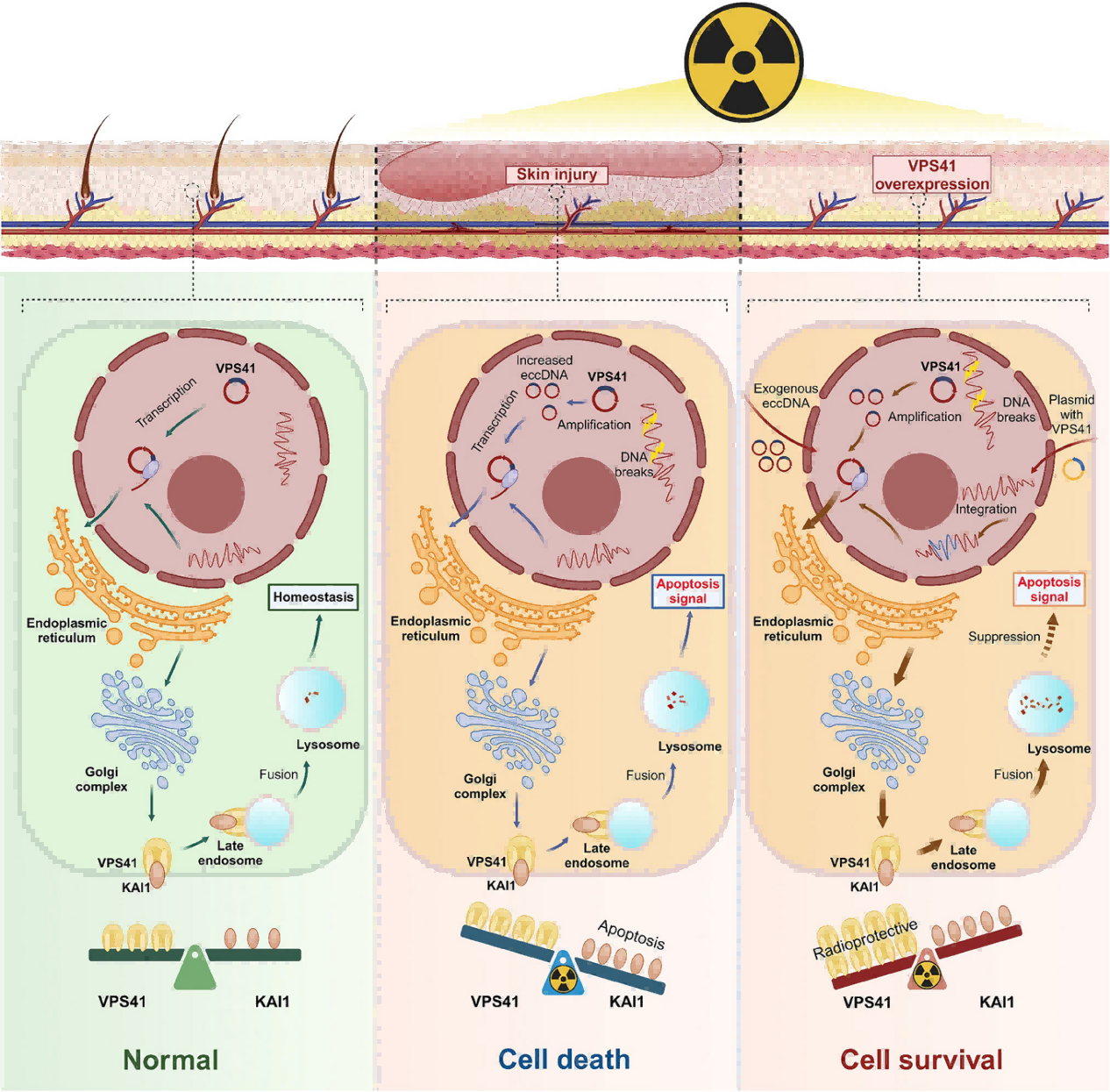
(機制圖解)
03 肝癌潛在治療靶點——SLC13A3
[題目]:SLC13A3 is a major effector downstream of activated β-catenin in liver cancer pathogenesis(SLC13A3是肝癌發(fā)病機制中激活β-catenin下游的主要效應因子)
[發(fā)表期刊]:Nature Communications(IF=14.7)
[DOI號]:10.1038/s41467-024-51860-2
[發(fā)表單位]:天津大學/加州大學伯克利分校等。
[引用產品]:細胞系SNU-398(CellCook)
[研究思路]:針對特定基因突變的信號通路中的新靶點作用研究
[研究內容]:肝癌是全球發(fā)病率死亡率排首位的癌癥,CTNNB1功能獲得性突變激活Wnt/β -catenin信號通路在肝癌發(fā)展中起關鍵作用,現(xiàn)有針對該通路或者通路β -catenin上游的抑制劑因給正常細胞帶來靶向毒性而存在局限性。本文通過多數(shù)據(jù)庫分析發(fā)現(xiàn)SLC13A3在具有功能獲得 (GOF) 突變體 CTNNB1(編碼 β-catenin 的基因)的人肝癌樣本中表達升高,并在對8種GOF CTNNB1突變和非CTNNB1突變的肝癌細胞系的SLC13A3蛋白水平檢測結果中驗證了β-catenin激活可上調SLC13A3的表達,而敲低CTNNB1則降低其表達;利用相關數(shù)據(jù)庫網(wǎng)站確定β -catenin/TCF4能直接結合SLC13A3啟動子調控其轉錄和活性。在研究 SLC13A3對細胞代謝的調控過程中發(fā)現(xiàn)SLC13A3是低親和力GSH轉運體,敲低它會減少細胞內GSH影響其合成前體氨基酸,且SLC13A3通過c-MYC信號下調SLC7A5減少亮氨酸攝取,影響mTOR通路。此外研究者通過細胞和動物實驗研究發(fā)現(xiàn)敲低或敲除SLC13A3會誘導β -catenin激活的肝癌細胞發(fā)生鐵死亡和自噬,抑制β -catenin驅動的肝癌發(fā)生。SLC13A3抑制劑ACA能抑制肝癌細胞生長,誘導自噬和鐵死亡,與索拉非尼有協(xié)同作用,在體內可有效抑制腫瘤生長。
[創(chuàng)新點]:首次揭示了β-catenin激活下游的關鍵效應因子SLC13A3及其重要性,為針對攜帶GOF CTNNB1突變的肝癌患者開發(fā)新的治療策略提供了潛在的靶點。
【參考文獻】
[1] Wang Y, Fan J, Meng X, Shu Q, Wu Y, Chu GC, Ji R, Ye Y, Wu X, Shi J, Deng H, Liu L, Li YM. Development of nucleus-targeted histone-tail-based photoaffinity probes to profile the epigenetic interactome in native cells. Nat Commun. 2025 Jan 6;16(1):415. doi: 10.1038/s41467-024-55046-8. PMID: 39762271; PMCID: PMC11704063.
[2] Shi B, Yang P, Qiao H, He J, Song B, Bai H, Jiang F, Zhang Y, Li Q, Yan T, Tu W, Yu D, Zhang S. EccDNA-Driven VPS41 Amplification Alleviates Genotoxic Stress via Lysosomal KAI1 Degradation. Adv Sci (Weinh). 2025 Apr 24:e2501934. doi: 10.1002/advs.202501934. Epub ahead of print. PMID: 40271553.
[3] Zhao W, Wang X, Han L, Zhang C, Wang C, Kong D, Zhang M, Xu T, Li G, Hu G, Luo J, Yee SW, Yang J, Stahl A, Chen X, Zhang Y. SLC13A3 is a major effector downstream of activated β-catenin in liver cancer pathogenesis. Nat Commun. 2024 Aug 30;15(1):7522. doi: 10.1038/s41467-024-51860-2. PMID: 39215042; PMCID: PMC11364541.
[發(fā)表期刊]:Nature Communications(IF=14.7)
[DOI號]:10.1038/s41467-024-51860-2
[發(fā)表單位]:天津大學/加州大學伯克利分校等。
[引用產品]:細胞系SNU-398(CellCook)
[研究思路]:針對特定基因突變的信號通路中的新靶點作用研究
[研究內容]:肝癌是全球發(fā)病率死亡率排首位的癌癥,CTNNB1功能獲得性突變激活Wnt/β -catenin信號通路在肝癌發(fā)展中起關鍵作用,現(xiàn)有針對該通路或者通路β -catenin上游的抑制劑因給正常細胞帶來靶向毒性而存在局限性。本文通過多數(shù)據(jù)庫分析發(fā)現(xiàn)SLC13A3在具有功能獲得 (GOF) 突變體 CTNNB1(編碼 β-catenin 的基因)的人肝癌樣本中表達升高,并在對8種GOF CTNNB1突變和非CTNNB1突變的肝癌細胞系的SLC13A3蛋白水平檢測結果中驗證了β-catenin激活可上調SLC13A3的表達,而敲低CTNNB1則降低其表達;利用相關數(shù)據(jù)庫網(wǎng)站確定β -catenin/TCF4能直接結合SLC13A3啟動子調控其轉錄和活性。在研究 SLC13A3對細胞代謝的調控過程中發(fā)現(xiàn)SLC13A3是低親和力GSH轉運體,敲低它會減少細胞內GSH影響其合成前體氨基酸,且SLC13A3通過c-MYC信號下調SLC7A5減少亮氨酸攝取,影響mTOR通路。此外研究者通過細胞和動物實驗研究發(fā)現(xiàn)敲低或敲除SLC13A3會誘導β -catenin激活的肝癌細胞發(fā)生鐵死亡和自噬,抑制β -catenin驅動的肝癌發(fā)生。SLC13A3抑制劑ACA能抑制肝癌細胞生長,誘導自噬和鐵死亡,與索拉非尼有協(xié)同作用,在體內可有效抑制腫瘤生長。
[創(chuàng)新點]:首次揭示了β-catenin激活下游的關鍵效應因子SLC13A3及其重要性,為針對攜帶GOF CTNNB1突變的肝癌患者開發(fā)新的治療策略提供了潛在的靶點。
【參考文獻】
[1] Wang Y, Fan J, Meng X, Shu Q, Wu Y, Chu GC, Ji R, Ye Y, Wu X, Shi J, Deng H, Liu L, Li YM. Development of nucleus-targeted histone-tail-based photoaffinity probes to profile the epigenetic interactome in native cells. Nat Commun. 2025 Jan 6;16(1):415. doi: 10.1038/s41467-024-55046-8. PMID: 39762271; PMCID: PMC11704063.
[2] Shi B, Yang P, Qiao H, He J, Song B, Bai H, Jiang F, Zhang Y, Li Q, Yan T, Tu W, Yu D, Zhang S. EccDNA-Driven VPS41 Amplification Alleviates Genotoxic Stress via Lysosomal KAI1 Degradation. Adv Sci (Weinh). 2025 Apr 24:e2501934. doi: 10.1002/advs.202501934. Epub ahead of print. PMID: 40271553.
[3] Zhao W, Wang X, Han L, Zhang C, Wang C, Kong D, Zhang M, Xu T, Li G, Hu G, Luo J, Yee SW, Yang J, Stahl A, Chen X, Zhang Y. SLC13A3 is a major effector downstream of activated β-catenin in liver cancer pathogenesis. Nat Commun. 2024 Aug 30;15(1):7522. doi: 10.1038/s41467-024-51860-2. PMID: 39215042; PMCID: PMC11364541.

























 銷售咨詢
銷售咨詢 技術支持
技術支持

